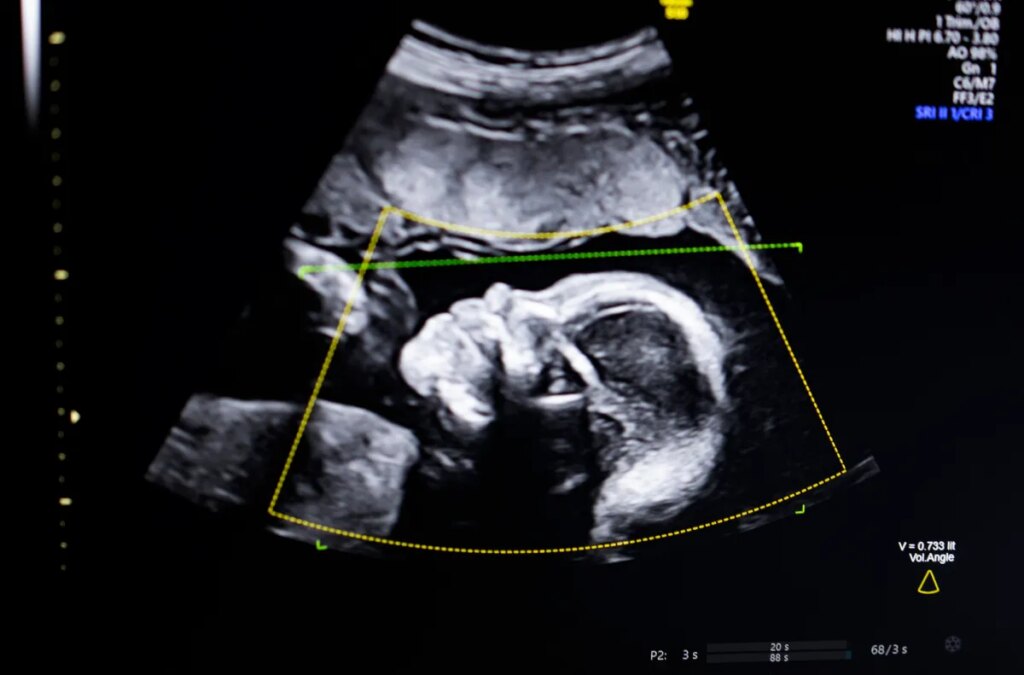
Biotics AI, ganador de TechCrunch Disrupt Battlefield 2023, anunció el lunes que recibió la autorización de la FDA para su software de inteligencia artificial que ayuda a detectar anomalías fetales en imágenes de ultrasonido.
La idea del producto surgió del fundador y director ejecutivo Robhy Bustami, quien creció en una familia de obstetras que incluía a su madre, su hermana y su tío. Cuando era niño, pasó mucho tiempo en hospitales y a menudo viajaba con su madre, quien cuidaba a madres en todo Estados Unidos.
Después de aprender a codificar y estudiar informática en UC Irvine, Bustami se asoció con Salam Khan, Chaskin Saroff y el Dr. Hisham Elgammal para llevar Biotics AI al mercado.
La tecnología utiliza IA de visión por computadora “para respaldar la evaluación de la calidad de la ecografía fetal, la integridad anatómica, los informes automatizados y la integración perfecta en los flujos de trabajo clínicos”, dijo Bustami a TechCrunch.
Espera que su tecnología ayude a Estados Unidos a combatir el hecho de que los resultados prenatales de las madres estadounidenses se encuentran entre los peores entre los países de altos ingresos. Las mujeres negras en particular enfrentan tasas de mortalidad materna muy altas.
Bustami dijo que la ecografía prenatal se ha convertido en la “piedra angular” del seguimiento del embarazo, pero sus imágenes de baja calidad pueden llevar a diagnósticos erróneos.
Bustami dijo que la parte más difícil no fue construir sus modelos de IA entrenados en una variedad de 11.000 imágenes de ultrasonido, sino garantizar que la tecnología funcione de manera confiable en el mundo real, particularmente entre las poblaciones con mayor riesgo de sufrir un resultado trágico.
Evento tecnológico
san francisco
|
13-15 de octubre de 2026
“En un entorno donde las disparidades en los resultados de salud están bien documentadas, era fundamental demostrar un desempeño consistente en todos los subgrupos de pacientes, y no solo en los casos idealizados”, continuó Bustami.
El director ejecutivo dijo que tomó casi tres años pasar por el proceso de la FDA, incluidas las pruebas y la validación del producto. Esta experiencia les ha demostrado a él y a su equipo lo importante que es que el trabajo técnico, relacionado con el producto, clínico y regulatorio esté estrechamente coordinado desde el principio. “Al diseñar el producto, la validación clínica y la vía regulatoria de forma conjunta en lugar de secuencialmente, pudimos avanzar rápidamente”, afirmó.
Con la aprobación de la FDA, Bustami dijo que el próximo enfoque de las compañías ahora es expandirse a varios sistemas de atención médica en todo el país. También planea agregar más funciones para la medicina fetal y la salud reproductiva.
“Tenemos la capacidad de escalar tanto las ventas como el impacto clínico mientras continuamos expandiendo el poder de nuestra tecnología”, dijo.





